一、質量追溯體系官方解讀 2016年04月28日,總局官網公布了《總局辦公廳公開征求《關于進一步完善食品藥品追溯體系的意見(征求意見稿)》的意見》,這是自《國務院辦公廳關于加快推進重要產品追溯體系建設的意見》(國辦發〔2015〕95號)發布以來,官網第一次詮釋“質量追溯體系”。
電子監管碼暫停沉寂了數月后,質量追溯體系征求意見稿出臺,自2015年7月22日CFDA發布史上最嚴的數據核查要求以來,藥企面臨又一數據核查。
藥品生產全過程使用
計算機系統管理!
征求意見稿指出:藥品生產經營企業須對藥品生產經營過程中的物料采購、生產、檢驗、放行和藥品采購、驗收入庫、養護、銷售出庫等環節操作進行認真審核記錄,確保各項記錄完整準確真實,并使用計算機系統進行有效管理。
藥企目前執行GMP(生產質量管理規范)最大的難題是實際生產工藝與注冊申報工藝不致,在這方面制藥論壇有很多的討論,這里不一一贅述,這里要說的是,據一項調查,80%的網友認為存在有工藝不一致的情況。
工藝不一致的范圍很廣,有生產過程步驟或工藝參數不一致;有原料或輔料用量不一致;有輔料種類不一致等等……種種的不一致,造成藥企GMP與實際二張皮,二套帳,甚至二套記錄。
如果總局硬要推行藥品生產從物料采購、生產、檢驗、放行都全過程使用計算機化系統管理,那么藥品生產企業相當于“全裸”“全透明”地呈現在監管部門面前,完整、全過程而不可更改的數據鏈,正是點中了藥企的死穴。
藥企面臨的出路有2條:1、工藝不一致的品種不生產。2、變更工藝,使工藝一致。
二、藥品電子監管碼與質量追溯有何不同? 藥品電子監管碼,只實現了包裝過程到市場流向的追溯。
從征求意見稿提到:企業建立追溯體系的目的是在發生產品質量問題時,及時召回產品,防控風險;便于經營者和消費者確認產品的真實性,以利于消費者權益受到侵害時索賠。
以及結合藥品生產經營企業須對藥品生產經營過程中的物料采購、生產、檢驗、放行實現全過程計算機管理來看,質量追溯實現的目標是,消費者或市場終端發生問題,立即可以對銷售過程、生產過程、檢驗過程、原輔料采購等所有環節進行追溯。
說白了,電子監管碼,只是質量追溯體系的一部分。
企業可自主選擇第三方,政府不得強制。
征求意見稿指出:鼓勵生產經營企業運用信息技術建立食品藥品追溯體系。鼓勵信息技術企業作為第三方,為生產經營企業提供產品追溯專業服務。各級食品藥品監管部門不得強制要求食品藥品生產經營企業接受指定的專業信息技術企業的追溯服務。
征求意見稿指出:麻醉藥品、精神藥品生產經營企業按照《麻醉藥品和精神藥品管理條例》有關監控信息網絡的要求,建立追溯體系。具體由食品藥品監管總局另行規定。
三、浙江某藥廠SPC質量管理系統實施 浙江某制藥股份有限公司是一家跨地區、集醫藥研發、生產、銷售于一體的醫藥上市公司,國家重點高新技術企業。公司現有員工1300余人,總占地面積1200多畝。 “鹽酸左氟”、“鹽酸環丙”等原料藥國內產銷量和市場占有率均名列前茅,產品暢銷東南亞、南亞、拉美、歐洲等國際市場,瑞舒伐他汀鈣原料和制劑已經形成規模化生產。
公司全面普及質量理念,固體制劑生產線在2006年首次通過德國GMP認證,2011年通過新版GMP認證,2012年又再次通過了德國(歐盟)GMP復認證。原料藥辛伐他汀、鹽酸環丙沙星也已先后取得了的COS證書,鹽酸環丙沙星還通過了EDQM的現場檢查,同時還獲得了法國GMP證書。
自2010年起,公司連續登榜中國化學制藥企業百強榜,社會知名度和美譽度日益提升。
2016年總局新政頒布之前已經開始在全產線,浙江XX有限公司的所有車間都已經使用QSmart
SPC質量管理系統。結合車間看板,喇叭,智能終端以及穩定的SPC質量管理系統,該公司已經完備了自己全線產品的質量追溯體系。從原料輔料到包裝都有完整的數據信息儲存于云網絡。
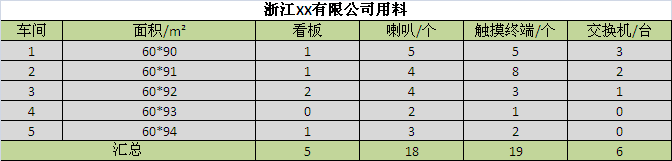
浙江某藥廠SPC系統布置用料 另外基于SPC的生產預警,數據分析的特點,QSmart SPC實時監測,實時報警,還具備穩定產線,預防異常發生的功能。
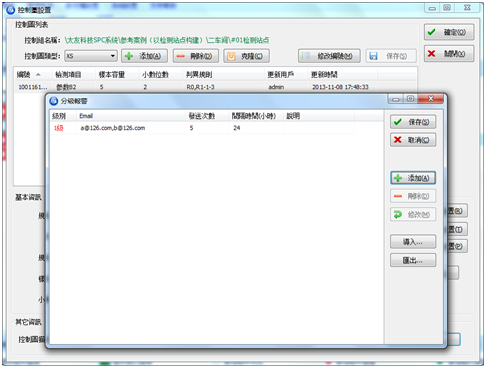
分級報警功能 如今該企業已經從生產工到管理層全面普及QSmart SPC的操作與分析功能。從生產信息的儲存,到質量波動的預警都比之前更高效,更精準。
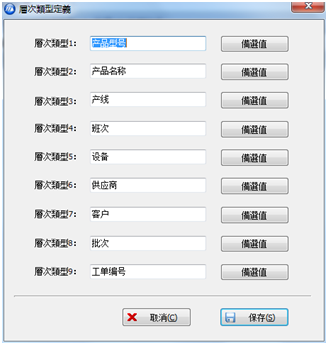 信息儲存類型
2017年,更多的政策要求,更多的客戶要求,是挑戰,也是機遇!
信息儲存類型
2017年,更多的政策要求,更多的客戶要求,是挑戰,也是機遇!